¿Qué es la entropía?
En nuestra vida a veces ocurren sucesos que nos gustaría revertir. Son sucesos con un resultado desagradable y en ocasiones quisiéramos retroceder en el tiempo para haber encajado la situación desde otra perspectiva, y haber obtenido con ello, un resultado más favorable para nosotros. Sin embargo, no podemos volver en el tiempo, eso es inevitable, al igual que hay procesos que no somos capaces de revertir a su estado inicial.
 Vector de Casa creado por vectorpouch – www.freepik.es «https://www.freepik.es/vectores/casa«
Vector de Casa creado por vectorpouch – www.freepik.es «https://www.freepik.es/vectores/casa«
Si buscamos en el diccionario de la RAE, tenemos dos acepciones:
- F. Fis. Magnitud termodinámica que mide la parte de la energía no utilizable para realizar trabajo y que se expresa como el cociente entre el calor cedido por un cuerpo y su temperatura absoluta.
- F. Fis. Medida del desorden de un sistema. Una masa de una sustancia con sus moléculas regularmente ordenadas, formando un cristal, tiene entropía mucho menor que la misma sustancia en forma de gas con sus moléculas libre y en pleno desorden.
Por lo que vemos dos definiciones que parecen contrarias; la primera hace referencia a la energía y la segunda a la materia.
Según la teoría de la relatividad de Albert Einstein, ambas quedan relacionadas en la siguiente expresión: E=mc2.
Por lo tanto, vemos que por una parte tenemos que, en los procesos termodinámicos hay una parte de la energía que no se va a poder utilizar para realizar un trabajo, y esa energía se va a degradar; simplemente pasará a un estado en el que no podrá ser utilizada nuevamente.
Por otra parte, en la segunda acepción, vemos que se asocia a un grado de desorden de un sistema, de ahí la imagen de cabecera; con una casa que parece que ha vivido una situación algo caótica y se encuentra todo desordenado.
No obstante, habrá advertido el lector que, con un poco de limpieza y orden, todo volverá a estar en su estado inicial.
A veces, para poder comprender el funcionamiento del universo, debemos afrontarlo desde un punto de vista simple, en algunos casos esa simplificación, cuando tenemos niveles pequeños de entropía nos permite simular el problema con si se tratara de un proceso reversible. En la naturaleza, eso no es posible, aparentemente podremos dejar la casa tal y como estaba, pero ni la materia estará tal y como estaba, ni podremos volver a utilizar la energía que se utilizó para desordenarla.
Después de ver un ejemplo sencillo, vamos a ver lo que sería la vida real, con procesos irreversibles.
 Foto de Wendelin Jacober en Pexels
Foto de Wendelin Jacober en Pexels
Vaya, parece que en este sistema hay un gran desorden, seguramente podamos afirmar que la entropía ha aumentado de forma importante.
En este caso, vemos claramente que hay elementos rotos que no podrán volver a estar tal y como estaban.
También vemos mucho caos, y este no nos permite interpretar como era esa vivienda en su estado original; se ha perdido información.
La entropía habitualmente tiene connotaciones negativas, por esa referencia al desorden y la pérdida de información que nos evocan mentalmente un aspecto destructor. Sin embargo, por el primer principio de la termodinámica sabemos que la energía no se crea, ni se destruye, tan solo se transforma; al igual que le sucede a la materia.
Ambas imágenes representan distintos estados del universo, y una parte de nuestro cerebro racional nos dice que la imagen bonita es la primera; porque representa el orden y la lógica, todo aquello que es predecible y nos aporta seguridad. Y la segunda imagen, en aquellas partes de nuestro cerebro más enfocadas a la intuición también nos dará mucha información.
Ambas imágenes son bellas, la primera porque vemos con los ojos y la segunda porque tenemos que interpretar que es lo que vemos, y nuestro sentido de la vista pasa a ser la mente.
Dado que el uso de la energía es uno de los mayores retos de la humanidad y consciente de la necesidad de un uso eficiente, uno de los procedimientos para limitar la entropía es realizar un ciclo cerrado. ¿Os acordáis de cuando hablaba de viajar al pasado? Bueno, no es posible, pero siempre os quedará mirar al cielo en una noche estrellada de verano.
Mientras tanto, una forma de reducir la entropía es manteniendo un ciclo constante que no permita disgregarse a la materia.
Cuando quemamos propano o butano en una caldera, parte de esa materia no quedará útil para continuar el mismo proceso, sin embargo, si lo sometemos a un ciclo cerrado de compresión de vapor, (mediante los refrigerantes R-290 y R-600) tendremos la misma obtención de energía, (aunque hayamos tenido que aportar una parte) y no haremos una transformación de la materia, más lejos de un cambio de fase.
 Foto de Mikhail Nilov en Pexels
Foto de Mikhail Nilov en Pexels
En los ciclos cerrado, la materia no tiene transformaciones químicas, solamente físicas, y eso nos permite realizar un proceso cíclico sin esa, si me permitís, “destrucción” de materia.
Podemos ver en la siguiente imagen, un ciclo frigorífico que plasma un suceso idealizado de la realidad sobre un diagrama de Mollier.
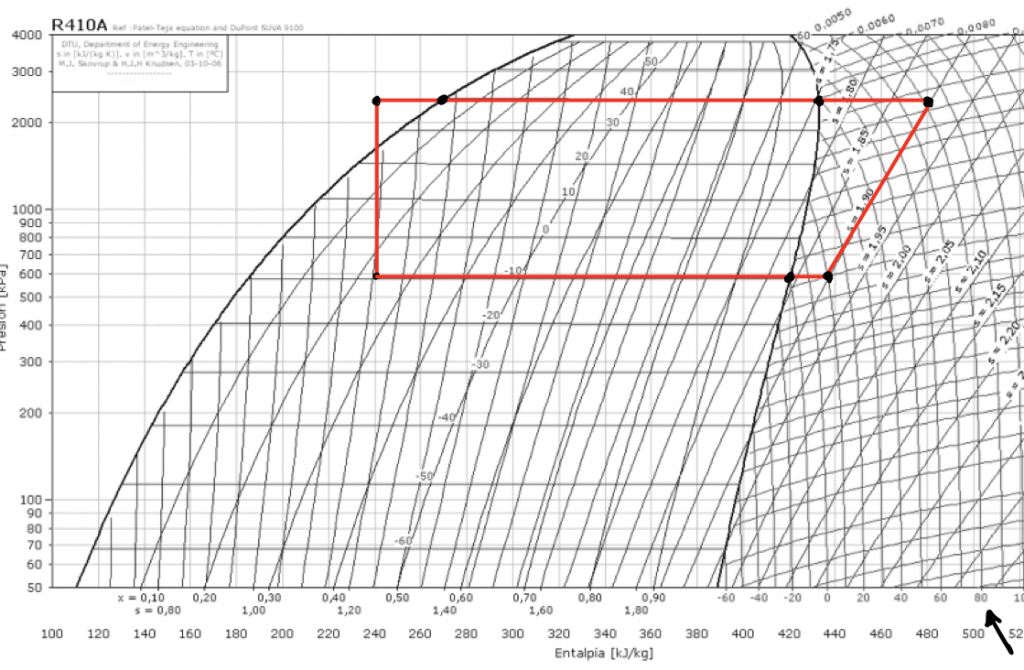
Tenemos un ciclo cerrado con dos isotermas-isobaras y dos adiabáticas. La adiabática de la izquierda corresponde a la expansión del refrigerante, la isoterma-isobara inferior corresponde la evaporación, la adiabática derecha viene marcada por las rectas de entropía constante, con lo cual siguiendo ésta hasta la temperatura de la isoterma-isobara superior, que corresponde a la condensación, tendremos la temperatura de salida del compresor. En este caso, lo he marcado con una flecha: 80ºC.
Como ya se ha dicho, esto no es un proceso real, y tampoco es un gas ideal, por lo que, para no hacerlo más complicado, teniendo en cuenta que la variación de entropía representa una parte pequeña de la energía aportada y aprovechada, podemos volver a la imagen inicial, y pensar que con un poco de limpieza el sistema estará otra vez como antes, y aplicarlo a este proceso, como si la entropía fuera constante.
De esta forma se estudian muchos fenómenos de la naturaleza, simplificando.
En cualquier caso, una cosa sí que será inevitable: no tendremos menos entropía al final que al principio.
Autor: Pablo García
Alumno del grado de Organización Industrial en la Udima




